您现在的位置:新闻首页>医药要闻
加速创新药早期工艺研发,新礼泰药业线上直播传授经验
我国从医药大国走向医药强国,创新药研发是必由之路。在创新药研发过程中,原料药始终处于先头部队的位置,IND阶段的原料药工艺开发则是先头中的先头,其进展将直接影响后续的制剂开发、临床前及临床研究,以及最终的商业化。如何加速新药的早期工艺研发,在IND阶段做好API工艺开发的管理,以及API工艺的质量控制,对于所有的制药公司都至关重要。
2022年4月21日下午,由张通社和博志研新联合主办、恺思俱乐部和火石数链协办的张通社Link沙龙第18期线上活动顺利展开。本次活动主题为《早期工艺研发策略与实例》,也是“新药IND阶段的药学开发”系列主题的首次直播活动。张通社邀请到了博志研新VP、新礼泰药业总经理叶方国博士,进行了一场干货满满的线上分享。直播活动在线上观看平台累计观看人数达到1000余人,大家就早期工艺研发的策略和质量控制等问题进行了踊跃的交流探讨,活动效果显著。
本场直播中,叶方国博士概述了早期工艺研究的内容、关注重点和应对策略,通过实例分析如何快速开展早期工艺研发,并对早期工艺研发中的分析研究和质量控制进行了基本介绍。
叶方国是日本冈山理科大学应用化学博士、加拿大渥太华大学博士后,拥有20余年新药研发管理和工艺开发管理经验,擅长小分子创新药候选化合物设计及工艺技术研发及产业化生产。
01 早期工艺研究的内容和关注重点
在药物化学阶段,获得一个药物化学合成物后,需要对它进行临床前和临床的研究,早期工艺研发主要涵盖了临床前和临床I期的研究,目的是快速开发出一条可以放大的工艺,保障所有原料药在早期阶段研发工作能高效快速平行推进,并无缝连接I期临床用API的生产。
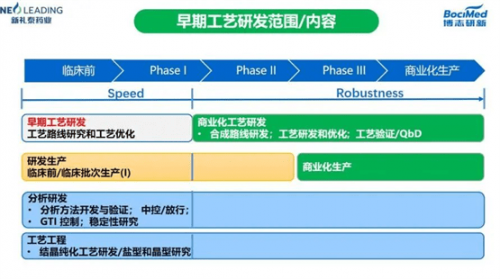
早期工艺研发的内容主要包含四个方面:工艺路线研究和工艺优化、临床前/临床批次生产(I)和分析研发和工艺工程。
随着有机化学的蓬勃发展,陆续出现了许多新反应、新技术、新试剂,在药物发现阶段,药物化学家们喜欢使用一些新方法来构建他们心中理想的药物分子。
但由于药物分子的结构越来越复杂,呈现多取代杂环、多手性中心的特征,缺乏合适的RSM,合成步骤多,加之新反应参考资料的稀缺,放大合成具有不可预测性,早期工艺研发面临大的挑战。因此早期工艺研发需要重点关注时间上的高效快速、工艺安全、质量控制(尤其是基因毒杂质)、经济效应(成本和劳动力)四个维度。
02 如何快速高效地开展早期工艺研发?
对于药物候选化合物来讲,其早期的开发价值尚未明确,同时新药的早期研发失败率相当高,然而进行理想的工艺开发,需要投入大量人力物力和时间,对早期工艺研发来讲会造成较大的资源浪费。早期工艺研发目的就是快速制备充足的达标的API,用于药理、毒理和I期临床的研究,所以快速的API供给是早期工艺研发优先考虑项。
那么如何快速高效地推进早期工艺研发?叶方国博士指出,药化路线是一个很好的抓手。以快速为目标,第一项工作就是进行工艺路线研究和工艺优化,快速评估可能的合成方法,优先考虑要采用的药化路线,集中解决重点工艺问题,在这过程中可采用非理想的合成工艺。
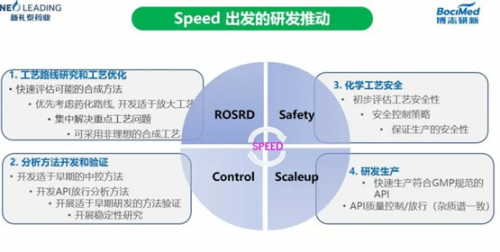
其次是分析方法的开发和验证,开发适于早期的中控方法、开发API放行分析方法、开展适于早期研发的方法验证和稳定性研究;第三是要解决化学工艺安全问题,初步评估工艺安全性,必要时制定安全控制策略,以保证生产的安全性;最后是在研发生产上要快速生产符合GMP规范的API,对API质量控制或放行有严格的标准,确保杂质谱一致。
随后,叶方国博士结合药化路线不适合放大的实例,指出可以在药化路线的基础上,集中解决重点工艺问题,同时采用非理想的合成工艺,来快速完成早期的工艺研发。在该实例中,通过基于新路线的开发、基于安全的优化、基于杂质控制的优化,明显提高了反应可放大性和反应效率,初步解决安全问题,成功实现了公斤级生产,从而保障API的快速生产和供给,快速推动了该潜在药物的早期研究。
03 早期工艺研究中的质量控制
在早期的工艺开发中,质量研究着重采用“通用”的方法,即按照药典一般要求,进行相关的研究,以保证化合物的质量的可控;根据起始原料/中间体及其杂质的信息,确定API检测项目、方法和质量标准;临床用样品的原料药的杂质含量水平应当符合相应的法规和指导原则的要求。
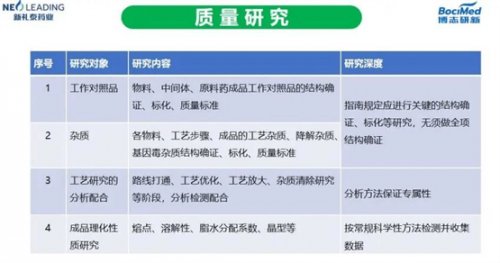
针对不同的研究对象,质量研究的深度也不同。例如对工作对照品和杂质,NMPA创新药相关指南规定应进行关键的结构确证、标化等研究,无须做全项结构确证。工艺研究的分析配合方面,保证分析方法的专属性,对成品理化性质研究只要按常规科学性方法检测并收集数据即可。
此外,在早期工艺研究中,还需要进行初步的稳定研究,考察API在拟定条件下主要理化性质的改变速度,确保所制备样品能支持新药在临床研究期间符合质量要求。其中涉及到的影响因素包括高温、高湿、光照等剧烈条件,操作上应当在法规所列的条件下开展稳定性研究,样品选择上最好是挑选临床批次工艺条件下生产的样品,并根据临床研究所需的时长来制定稳定性研究的时长。
“企业以药化路线为基础,重点解决工艺问题,在质量控制上重点关注基因毒杂质的控制,遵守严格的时间管理,高效快速的早期工艺研发工作就能顺利进行,早日达到早期工艺研发的目标。”——叶方国博士
在高难度药物的全合成、工艺优化方面,博志研新子公司新礼泰药业主要服务范围涵盖小分子原料药、中间体定制及研发一体化服务,可实现快速合规交付的优良服务。新礼泰发挥在CMC方面的显著优势,致力于为全球新药企业提供高效、高质量的CDMO服务,助力客户新药更快上市。
- 凡本网注明"来源:中国医药卫生网的所有作品,版权均属于中中国医药卫生网,转载请必须注明中中国医药卫生网,http://www.medicinesx.com。违反者本网将追究相关法律责任。
- 本网转载并注明自其它来源的作品,目的在于传递更多信息,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品来源,并自负版权等法律责任。
- 如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。









